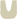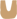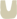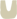原理
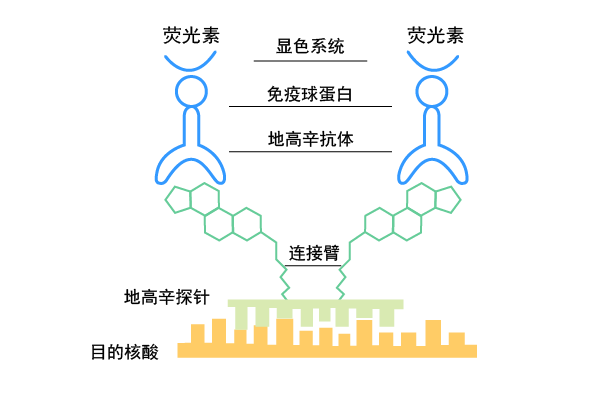
首先,染色体中的目的基因与带有地高辛或生物素标记的互补序列DNA或RNA探针杂交形成较稳定的杂交复合物。接着探针上的地高辛再与连接荧光素的抗地高辛抗体,或生物素再与连接荧光素的抗生物素抗体进行抗原-抗体反应结合。由于标记的荧光素在荧光显微镜下经过不同波长的激发光激发,可发射出不同颜色的荧光,因此,通过荧光素发射出的荧光可检测出目的基因在染色体中的分布位置。图1为地高辛-抗地高辛系统检测原位杂交示意图。
仪器设备
| 1.温箱。 | 2.高压灭菌锅。 |
| 3. 微量加样器。 | 4.荧光显微镜。 |
| 5.显微镜。 | 6.恒温水浴锅。 |
| 7.载玻片,盖玻片。 | 8.酒精灯。 |
9.湿盒(取-一个大的培养皿,垫几层滤纸,用2X SsC溶液浸湿)。
|
试剂
1.3 X PBS(磷酸缓冲液):390mmol•L-1NaCl、30 mmol•L-1 Na2HPO4和390 mmol•L-1NaCl、30 mmol•L-1 Na2HPO4,按1 :1混合得到3X PBS,pH7.0,用蒸馏水稀释成1X PBS。
2.20 X SSC( standard saline citrate) : NaCl 175g,柠檬酸三钠88g,用双蒸水溶解,1 mol•L-1 HCI调节pH为7.0,双蒸水定容至1000mL。其他各级SSC可由贮存液加双蒸水稀释获得。
3.卡诺固定液:95%乙醇:冰醋酸=3: 1。4.各级乙醇,45%乙酸,1%醋酸洋红。
4.各级乙醇,45%乙酸,1%醋酸洋红。
5. 70%甲酰胺/2XSSC:35mL甲酰胺,5mL 20 X SSC,10mL水。
6. 50%硫酸葡聚糖(DS):65℃水浴中融化,4℃或一20℃保存。
7.杂交液:100%甲酰胺20μL,50%DS8μL,20 X SSC 4 μL,探针4 μL(加前100℃加热标记的探针2 min,立即放在冰上冷却,使探针变性),封阻DNA50倍于探针DNA,10% SDS 2 μL,去离子水定容至40 μL。
8. PI( propidium iodide)/ antifade溶液
PI原液:先以双蒸水配置溶液,浓度为100μg•mL-1,取出1mL,加39mL双蒸水,使终浓度为2.5 μg•mL-1。
antifade原液:以PBS缓冲液配制该溶液,使其浓度为10mg•mL-1 ,用0.5 mmol•mL-1的NaHCO3调pH为8.0。取上述溶液1mL,加9mL甘油,混匀。
PI/antifade溶液:PI与antifade原液按体积比1 :9比例充分混匀,一20℃保存备用。
9.生物素或地高辛荧光检测试剂盒。
10. TE(Tris/EDTA) 液:10 mmol•L-1 Tris- HC1,1 mmol•L-1 EDTA,pH8.0。
材料
洋葱、蚕豆、大麦、小麦、大豆根尖。
方法步骤
1.中期染色体压片的制备
(1)取样:用刀片切下根尖,置于冰水共存的冰瓶中0~3℃处理24h。目的是获得较多中期分裂相的细胞。
(2)固定:经预处理的材料冲洗干净后,用卡诺氏固定液20℃固定20h,如果材料不立即进行压片,可置于70%乙醇溶液中待用。
(3)染色:将固定后的材料放人盛有1%醋酸洋红染色液中染色2~4h。
(4)分散与压片:将染色后的根尖放在干净的载玻片上,去掉根冠和伸长区部分,只留2~3mm长的分生区部分。加1滴45%乙酸,用镊子将根尖充分压碎,加盖盖玻片。在酒精灯,上微加热,稍冷却后,左手食指压紧盖片一个角,右手持解剖针,以针尖轻轻敲击盖片, 使细胞均匀分散。然后,再换用解剖针的木柄端敲击盖片,使细胞压平。*后,在该片上垫一滤纸片,用拇指紧压使其更平。
(5)干燥压片:记下分散良好的中期细胞的坐标,并在盖玻片上标记位置后,将载玻片浸人液氮中速冻,再用解剖刀迅速掀掉盖玻片立即浸人95%乙醇中至少5s,空气中干燥。
2.探针的制备:按缺口平移DNA标记(Bio-11-dUTP或Dig-11-dUTP)试剂盒操作。
(1)取10μL模板DNA加入一新的离心管中,100℃加热2min,立即转移到冰浴内冷却,12000g离心15 min。
(2)倒掉上清液放在冰上,加入下列试剂:
10 μL Bio-11-dUTP或Dig-11-dUTP标记的混合dNTP;
5μLDNA聚合酶I;
5μL新稀释的DNaseI(取2μLDNaseI加988μL重蒸水);
双蒸水加至50μL,短暂离心收集反应液在离心管的底部。
(3)置15。C水浴中2h。
(4)加5μLTE终止反应。
3.原位杂交
(1)染色体压片的变性:将染色体压片在60℃烘箱干燥1h后,用RNase A 37摄氏度处理1 h,
2 X SSC漂洗5min,70%去离子甲酰胺70℃变性2~3 min,再分别在-20℃预冷的70%、80%、90%、100%乙醇中各脱水5min,空气干燥。
(2)杂交:变性处理后的每张压片加40mL杂交液,覆盖盖玻片后置湿盒中,60℃温浴10min,37℃杂交过夜。
(3)漂洗:2XSSC室温10min,30%去离子甲酰胺37℃ 10 min,2 X SSC室温10 min,1 X SSC室温10 min,PBS冲洗平衡。
(4)加稀释的兔抗生物素或地高辛抗体40μL,置湿盒中37℃浮育1h。
(5)PBS漂洗4次,每次10 min。
(6)加荧光素(FITC)标记的羊抗兔免疫球蛋白溶液,置湿盒中37℃浮育1 h。
(7) PBS漂洗4次,每次10 min。
(8)用PI/antifade溶液染色2 min。
(9)蒸馏水漂洗4次,每次10 min。
(10)加盖盖玻片,用无荧光封片剂封片,荧光显微镜下观察。
注意事项
1. DNaseI的作用是在DNA双链上作用产生缺口,它的浓度和反应的时间长短与标记的探针的长度密切相关,通常以DNA片段长约300~500 bp为宜。如片段较大,会使探针的渗透性降低,降低杂交率。这时应加适量DNaseI继续酶切,直至DNA片段长度合适后,加5μLTE终止反应;如果DNaseI的浓度太大或酶切时间过长会使合成的探针太短,容易产生非特异结合,造成本底增加。因此,*好用8.0g•L-1琼脂糖/TBE缓冲液凝胶电泳检测标记探针的大小。
2.探针与目的DNA的特异性一定要强。
3.在制备中期染色体压片时,载玻片一定要清洗干净,否则染色体容易掉。
 生化检测
生化检测 液相(HPLC)检测
液相(HPLC)检测